CHUYÊN ĐỀ 1
BÀI TOÁN VỀ CẤU TẠO NGUYÊN TỬ, CẤU HÌNH ELECTRON,
BẢNG HỆ THỐNG TUẦN HOÀN
I. Nội dung trọng tâm.
1. Cấu tạo nguyên tử.
Nguyên tử của một nguyên tố được cấu tạo bởi 3 loại hạt cơ bản n, p, e.
Lớp vỏ gồm: các hạt e mang điện tích -1 và |q| = 1,6.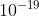 C.
C.
Hạt nhân được cấu tạo bởi 2 loại hạt cơ bản là n không mang điện và p mang điện tích +1.
Vận dụng các tính chất sau để làm bài:
Hạt nhân được cấu tạo bởi 2 loại hạt cơ bản là n không mang điện và p mang điện tích +1.
Vận dụng các tính chất sau để làm bài:
- Số khối A = n + p = N + Z
- Nếu đề ra không cho đủ dữ liệu ta vận dụng thêm:
2. Cấu hình electron.
Trước hết, cần nắm được cácelectron chuyển động quanh hạt nhân theo một quỹ đạo có mức năng lượng xác định tạo ra các lớp và phân lớp.
- Lớp electron, gồm các phân lớp có mức năng lượng gần bằng nhau.
- Phân lớp, gồm các electron có mức năng lượng bằng nhau:
+ Lớp: 1 2 3 4 5 6 7
K L M N O P Q
+ Phân lớp: s p d f
Lớp 1: có 1 phân lớp 1s
Lớp 2: có 2 phân lớp 2s 2p
Lớp 3: có 3 phân lớp 3s 3p 3d
Lớp 4: có 4 phân lớp 4s 4p 4d 4f
Lớp 5: có 5 phân lớp 5s 5p 5d 5f
Cấu hình mức năng lượng 1s 2s 2p 3s 3p 4s 3d..., do có sự chèn mức năng lượng của phân lớp d và s.
3. Bảng tuần hoàn các nguyên tố hóa học
Các nguyên tố trong bảng hệ thống tuần hoàn được sắp xếp theo sự tăng dần của điện tích hạt nhân:
-Trong một phân nhóm A các nguyên tử có cùng số electron lớp ngoài cùng.
- Trong một chu kỳ các nguyên tố có cùng electron.
4. Đồng vị hóa học:
- Các nguyên tử của nguyên tố có cùng điện tích hạt nhân.
- Có số khối khác nhau.
Một nguyên tố X có các đồng vị:
Công thức:
Theo: Những nội dung trọng tâm trong đề thi ĐH-CĐ môn Hóa Học - Chủ biên: Thầy Trần Khải - Giáo viên luyện thi ĐH môn Hóa tại Hocmai.vn - NXB ĐH Quốc gia Hà Nội.

0 nhận xét:
Đăng nhận xét